ビュー: 0 著者: サイト編集者 公開時間: 2023-08-21 起源: サイト
プロテインマーカーの定義と使用法
プロテイン マーカーは、分子量が既知のタンパク質の混合物であり、タンパク質のバンドのサイズを示す「定規」として使用されます。
ウェスタンブロットのプロセスでは、分子量マーカーはネジのようなものですが、小さなリンクではありますが、実験結果に大きな影響を与える非常に小さな詳細です。マーカーの役割は主に、分子量のサイズに対応するタンパク質バンドの分子量を示すために使用され、標準量が正確で正確である場合にのみ、実験結果に説得力があり、タンパク質マーカーに加えて、膜がトランスフェクションされているかどうかも示されます。さらに、膜転写の成否やゲル上でのタンパク質の電気泳動の程度なども表示されます。したがって、適切なタンパク質マーカーを選択することも、ウェスタンブロット実験を成功させるための必要条件の1つです。
タンパク質マーカーの分類
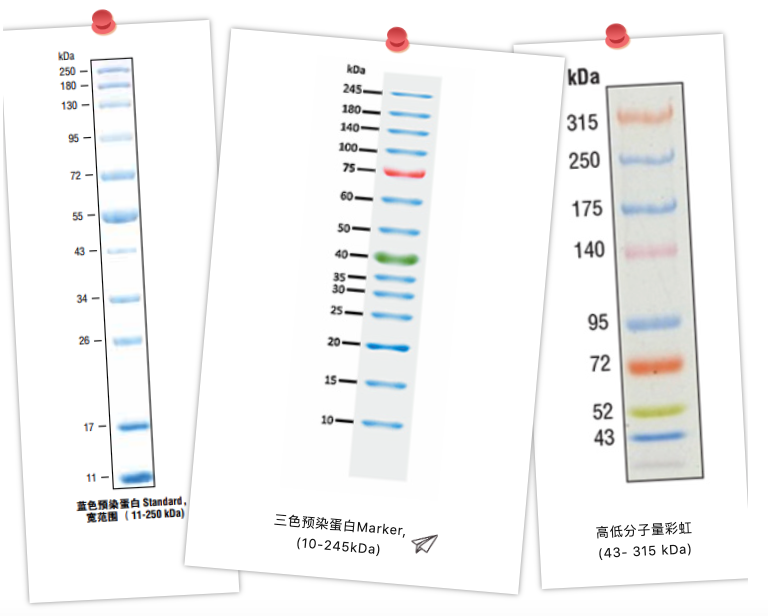
一般に、最も一般的に使用されるタンパク質マーカーは、非染色済みタンパク質マーカーと染色済みタンパク質マーカーに分類されます。
非染色プロテインマーカー
これは分子量が既知で精製されたいくつかのタンパク質のプレミックスであり、異なるサイズのタンパク質を比較するのに便利です。非染色済みマーカーは、電気泳動中に完全に見えず、電気泳動終了時のタンパク質染色後にのみ表示され、「後知恵」のタイプに属する実験プロセスの参照として使用できないため、染色済みマーカーほど優れていません。しかし、タンパク質には色素分子やマーカー分子が伴っていないため、表示されるサイズはタンパク質本来のサイズそのものであり、より正確にタンパク質のサイズを決定することができます。

プレミックスされたマーカーには、通常、濃度を 2 倍にする目安としていくつかのバンドが含まれています。これは、より多くのバンドが混合されるほど、覚えにくくなり、どれがどれであるか誰にも分からないためです。目がぼやけるまで数えるのは難しいです。したがって、特に集中しているものを見ると、マーカー バンドはそれらがどこにあるかを記憶します。ただし、小さいバンドは通常、それほど見えにくいことに注意してください。もちろん、選択に関しては、ターゲットタンパク質とサイズが似ているバンドを少なくとも 1 つ選択するのが最善であり、近ければ近いほど良いです。
プレステッドプロテインマーカー
染色済みタンパク質マーカーは、色素との共有結合によって混合されたいくつかの精製タンパク質であり、電気泳動または膜転写中に直接観察できます。
染色済みのタンパク質マーカーは実験に便利です。このタンパク質分子量標準は、電気泳動をモニタリングし、電気泳動中および電気泳動後、膜転写後における移動度を推定するのに役立ちます。たとえば、垂直電気泳動の最適な分解能ゾーンがゲルの約 2/3 であることがわかっている場合、プレ染色されたマーカーを使用して次のことが可能です。たとえば、垂直電気泳動の最適な分解能ゾーンはゲルの約 2/3 であることがわかっており、プレ染色されたマーカーを使用すると、ターゲットがいつターゲットに到達するかを予測できます。タンパク質は最適な分離ゾーンに入り、最適な分離効果を得るために電気泳動を停止します。マーカーの電気泳動に異常が観察された場合は、時間内に電気泳動を終了することもできます。さらに、ウェスタンブロットで膜に転写した後、タンパク質が膜に完全に転写されたかどうかを観察でき、膜上のタンパク質の分子量を標識することもできるため、多くの研究室が染色済みタンパク質標準を購入するのに注目しています。
染色済みタンパク質マーカーは色素と共有結合しているため、異なる緩衝液条件下で電気泳動すると泳動特性が変化し、何らかのずれが生じる可能性があるため、タンパク質の正確な位置特定には適していません。ただし、ほとんどの場合、マーカー上のバンドは標的タンパク質と同一ではなく、得られる結果は標的タンパク質とまったく同じです。ただし、ほとんどの場合、マーカー バンドはターゲット タンパク質とまったく同じではない可能性があり、得られるものはマーカーの表示に対する参照サイズにすぎず、最終的にはそれを特徴付けるためにウェスタンが必要となるため、類似したサイズのバンドを区別する必要がない場合でも、染色済みマーカーは依然として非常に有用であり、未染色のタンパク質標準と組み合わせて使用することもできます。
プレステッドタンパク質マーカーの分類
染色済みタンパク質マーカーは、モノクロ染色済みとマルチカラー染色済みタンパク質に分けられます。モノクロ染色済みタンパク質マーカーは、通常、いくつかのバンドを使用して特定のバンドの濃度を 2 倍にし、特定のバンドの厚さを深くしてサイズのサイズを示唆します。これにより、個々のバンドのサイズをすばやく記憶して区別できるようになります。カラータンパク質マーカーは異なる色で区別されるため、さらに認識しやすくなります。さらに、退屈な電気泳動実験中にカラフルなレインボーマーカーが出れば、そのときの気分もさらにハッピーに!
上記に加えて、市場には他にもいくつかの種類のタンパク質マーカーがあります: 蛍光タンパク質マーカー、ビオチン化マーカー、開発されたタンパク質マーカーなど。
また、タンパク質マーカーは分子量範囲により高分子量、低分子量、広分子量に分類されます。高分子量範囲のマーカーは大きな分子量のタンパク質に使用されることが多く、低分子量範囲のマーカーは小さなタンパク質や一部のペプチドに使用されることがよくあります。研究室全体を考慮する場合は、より均一なバンド分布を持つ幅広い分子量マーカーを選択してください。これにより、タンパク質がどの区間にあるかに関係なく簡単に判断できます。
マーカーに関するいくつかの問題
マーカーはすべて使い切る必要がありますか?
たとえば、取扱説明書には 7 つのバンドが記載されていますが、実際には 6 つのバンドが使い果たされるのが普通です。泳動時間が十分ではない可能性があります。タンパク質が非常に小さい場合は、ブロモフェノール ブルー フロントがゲルからなくなるまで待ってから電気泳動装置の電源を切ると、7 つのバンドが得られるはずです。バンドが 5 つになる場合もありますが、目的のタンパク質の上下 2 つのバンドを使い果たすことができれば、7 つのバンドである必要はありません。
マーカーがスマイリーフェイスに変わった場合はどうすればよいですか?
まず、ジェルはプレスされていません
第二に、プレートの端と接着剤の中央では接着剤の流動性が異なる場合がありますが、 これは粘度や表面張力によって異なります。さまざまな方法で上記の現象を解決できない場合は、サンプルのチャンネルを変更し、スイム レーンの中央付近のレーンを選択してランを実行するよう個人的にアドバイスします。
エッジエフェクトは、サンプルの2つのレーンの端ではこのようになります。電気泳動速度を遅くしてみると……
接着剤を準備するときにうまく押し付けられていない、接着剤が十分に準備されていない、電気泳動電圧が高すぎる、電気浸透力が強い、または電気泳動中にガラスプレートがうまくクランプされていない、内部の電気泳動溶液が漏れている、いずれかのいずれかを確認してください。
マーカーバンドの広がりの問題を解決するにはどうすればよいですか?
原因 1: サンプル量が多すぎるため、サンプル量を減らす必要があります。
対策:サンプル濃度やゲルの厚みに応じてサンプル量を柔軟にコントロールする必要があります。一般に、サンプル量は 10 ~ 15 μL (つまり、タンパク質 2 ~ 10 μg) です。サンプルが非常に希釈されている場合、サンプル量は 100μL に達することがあります。
原因 2: サンプルの溶解が不完全です。
対策:
(1) サンプルは完全に溶解する必要があります。 あらゆる種類のタンパク質サンプルを保存し、マーカーはサンプリング前に完全に溶解することができます。サンプリング前にサンプルを遠心分離し、溶解できない粒子を除去することをお勧めします。
(2) 分子量標準用タンパク質キットの要件に応じてサンプル溶解溶液を追加できます。 標準サンプルと未知サンプルが自己構成されている場合は、0.5 ~ 1.0 mg/L のサンプル溶解液に従ってください。溶解後、Ep チューブに移し、キャップをかぶせて (キャップにクリップを追加してもよい)、110 度のウォーターバスで 3 分間加熱します (薄い発泡スチロールの板に Ep チューブと同じ直径の丸い穴をいくつか開け、キャップの端がそれ以上下がらないように Ep チューブを置き、本体の大部分が露出する薄い発泡スチロールの板を置きます)。沸騰したお湯の中でepチューブ、沸騰したお湯の中に薄い発泡スチロールの板が自然に浮きます。薄い発泡スチロールのシートは沸騰したお湯の表面に自然に浮き、アクセスしやすく加熱しやすくなり、熱湯の飛び散りを防ぎます。
Ep チューブのバッチを沸騰水浴にさまざまな時間入れます。 (蓋が洗い流される可能性があるため、EP チューブを沸騰した湯の中に入れないでください。) その後、室温で冷却して使用します。サンプルを長期間使用しない場合は、サンプルを摂氏 -20 度の冷蔵庫に保管し、必要に応じてサンプルを室温で 110 度の沸騰水で 3 分間加熱し、冷却してから使用のために取り出し、サンプルを適用してサンプルタンパク質内の不安定な凝集体を除去します。
(3) サンプルが完全に溶解し、SDS の量が十分になるようにサンプル緩衝液を交換します。
理由: SDS バンドは電気泳動によって隣接するタンパク質に結合します。過剰なサンプリングやサンプルの不完全な溶解に加えて、ゲルのサンプルウェルの漏れによって電気泳動バンドが広がる可能性があります。漏れはゲルとガラスプレートの間の亀裂によって引き起こされることがよくあります。対策:現時点では、ゲルは再調製することしかできません。ゲルの凝集が完了するまでコームを引き上げる際に注意してください。速度が速すぎてはなりません。引き上げる方向はゲルの表面に対して垂直である必要があります。ゲルの両側のガラス板とゲルの間に亀裂が入るのを避けるため、ゲルの準備中にゲルの両側のガラス板を圧迫しないでください。