Definição e uso do marcador de proteína
O Marcador de Proteínas é uma mistura de proteínas de peso molecular conhecido, que é utilizado como uma “régua” para indicar o tamanho das bandas proteicas.
No processo de Western Blot, o marcador de peso molecular é como um parafuso, embora seja um pequeno elo, porém, é um detalhe tão pequeno que tem um efeito significativo nos resultados experimentais. O papel do marcador é usado principalmente para indicar o peso molecular das bandas de proteína correspondente ao tamanho do peso molecular, e somente se a quantidade padrão for precisa e correta, os resultados dos experimentos são convincentes, além do marcador de proteína também mostra se a membrana é transfectada ou não. Além disso, também mostra se a transferência da membrana foi bem-sucedida ou não, e o grau de eletroforese da proteína no gel, etc. Portanto, a escolha do marcador proteico correto também é uma das condições necessárias para o sucesso dos experimentos de Western Blot.
Classificação de Marcadores de Proteínas
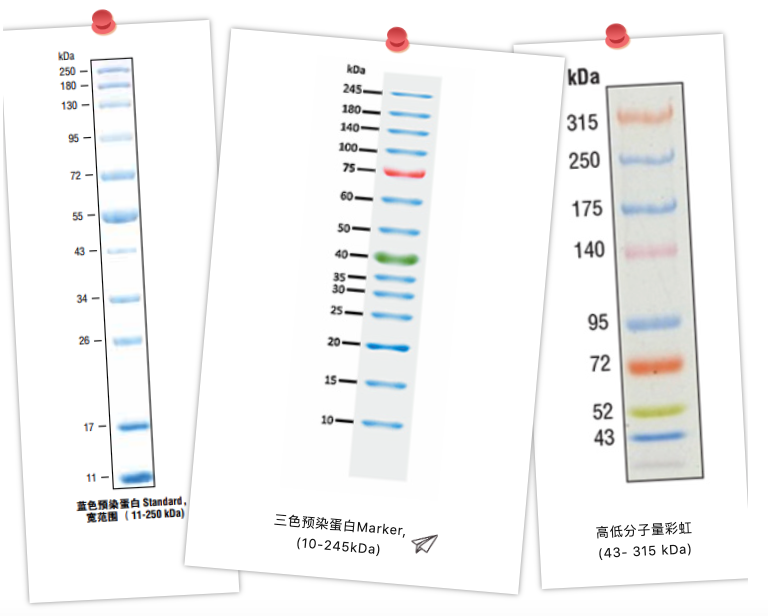
Em geral, os marcadores proteicos mais comumente utilizados são categorizados em marcadores proteicos não pré-corados e marcadores proteicos pré-corados.
É uma pré-mistura de diversas proteínas de peso molecular conhecido e purificadas, o que é conveniente para a comparação de proteínas de diferentes tamanhos. O Marcador não pré-corado não é tão bom quanto o Marcador pré-corado porque é completamente invisível durante a eletroforese, e só pode ser indicado após a coloração da proteína no final da eletroforese, e não pode ser usado como referência no processo experimental, que pertence ao tipo de 'retrospectiva'. No entanto, como a proteína não é acompanhada por uma molécula de corante ou de uma molécula marcadora, o tamanho mostrado é exatamente o tamanho original da proteína, por isso é mais preciso e pode determinar com precisão o tamanho da proteína.


O Marcador Pré-misturado costuma ter algumas bandas dobrando a concentração como indicação, pois quanto mais bandas são misturadas, pior é lembrar, quem sabe qual é essa! É difícil contar até que seus olhos fiquem embaçados. Assim, quando você vir os particularmente concentrados, as faixas marcadoras lembrarão onde estão. Lembre-se, porém, de que as faixas menores geralmente não são tão fáceis de ver. Em termos de seleção, é claro, é melhor escolher pelo menos uma das bandas que seja semelhante em tamanho à sua proteína alvo, quanto mais próxima melhor.
O Marcador de Proteína Pré-corado consiste em algumas proteínas purificadas misturadas por acoplamento covalente com um corante, que pode ser observado diretamente durante a eletroforese ou transferência de membrana.
Marcadores de proteínas pré-corados são convenientes para nossos experimentos. Este padrão de peso molecular de proteína pode nos ajudar a monitorar a eletroforese e estimar a mobilidade durante e após a eletroforese, bem como após a transferência de membrana - por exemplo, se for conhecido que a zona ideal de resolução para eletroforese vertical é cerca de 2/3 do gel, usando um marcador pré-corado é possível. a proteína alvo entra na zona de resolução ideal e interrompe a eletroforese para obter o efeito de resolução ideal; você também pode encerrar a eletroforese a tempo se observar uma anormalidade na eletroforese do Marcador; além disso, você pode observar se a proteína é transferida completamente para a membrana após a transferência da membrana no Western Blot e pode rotular o peso molecular da proteína na membrana, por isso atrai muitos laboratórios para comprar o padrão de proteína pré-corado.
Vale a pena notar que o marcador de proteína pré-corado é acoplado covalentemente ao corante, portanto as características de migração podem mudar quando eletroforese sob diferentes condições de tampão, o que pode levar a alguns desvios, por isso não é adequado para localização precisa de proteínas - no entanto, na maioria dos casos, as bandas no marcador podem não ser idênticas à proteína alvo, e os resultados que obtemos são iguais aos da proteína alvo. Porém, na maioria dos casos, as bandas do Marcador podem não ser exatamente iguais à nossa proteína alvo, e o que obtemos é apenas um tamanho de referência relativo à indicação do Marcador, e no final, precisamos do Western para caracterizá-lo, então se não precisarmos distinguir entre bandas de tamanhos semelhantes, o Marcador pré-corado ainda é muito útil, e também pode ser usado em conjunto com o padrão de proteína não corado.
Classificação do marcador de proteína pré-corado
O marcador de proteína pré-corado é dividido em: monocromático pré-corado e multicolorido pré-corado, o marcador de proteína monocromático pré-corado geralmente usa algumas das bandas para dobrar a concentração de certas bandas para aprofundar a espessura de certas bandas para sugerir o tamanho de seu tamanho, para que possamos memorizar e diferenciar rapidamente o tamanho das bandas individuais. Os marcadores de proteínas coloridos são diferenciados por cores diferentes, o que é ainda mais reconhecível. Além disso, se um marcador de arco-íris colorido aparecer em um experimento de eletroforese monótono, o clima ficará mais feliz neste momento!
Além do acima exposto, existem alguns outros tipos de Marcadores de proteínas no mercado: Marcadores de proteínas fluorescentes, Marcadores biotinilados, Marcadores de proteínas desenvolvidos, etc....
Além disso, os marcadores de proteína são categorizados em alto peso molecular, baixo peso molecular e amplo peso molecular de acordo com a faixa de peso molecular. Marcadores de faixa de peso molecular alto são frequentemente usados para proteínas de grande peso molecular, enquanto marcadores de faixa de peso molecular pequeno são frequentemente usados para proteínas pequenas ou mesmo alguns peptídeos. se você considerar todo o laboratório, escolha marcadores de amplo peso molecular com distribuição de bandas mais uniforme, para que suas proteínas possam ser facilmente avaliadas, independentemente do intervalo em que estejam.
Alguns problemas com o marcador
Por exemplo, o manual de instruções lista 7 bandas, na verdade, é normal acabar 6 bandas, pode ser que o tempo de execução não seja suficiente, se sua proteína não for muito pequena, você pode esperar que a frente do azul de bromofenol acabe do gel antes de desligar o aparelho de eletroforese, para que você consiga ter 7 bandas. Às vezes, haverá 5 bandas, mas contanto que as duas bandas superior e inferior da sua proteína alvo possam acabar, não precisa ser 7 bandas.
Primeiro, o gel não é pressionado
Em segundo lugar, a fluidez da cola na borda da placa e no centro da cola pode ser diferente, não há como fazer isso, com a viscosidade e a tensão superficial. Se uma variedade de métodos não puderem resolver o fenômeno acima, o conselho pessoal do fabricante para mudar um canal na amostra, escolha uma pista próxima ao centro da raia para correr.
Efeito de borda, na borda das duas pistas da amostra ficará assim. Você pode tentar uma velocidade de eletroforese mais lenta ......
Ou a cola não está bem prensada quando é preparada, a cola não está bem preparada, ou a voltagem da eletroforese é muito alta, a força eletroosmótica é forte, ou a placa de vidro não está bem fixada durante a eletroforese, e a solução interna de eletroforese está vazando, verifique-os um por um.
Causa 1: O volume da amostra é muito grande, o volume da amostra deve ser reduzido.
Contramedida: O volume da amostra deve ser controlado de forma flexível de acordo com a concentração da amostra e a espessura do gel. Geralmente, o volume da amostra é de 10-15μL (ou seja, 2-10μg de proteína). Se a amostra estiver muito diluída, o volume da amostra pode chegar a 100μL.
Causa 2: Dissolução incompleta da amostra.
Contramedidas:
(1) A amostra deve ser totalmente dissolvida: mantenha todos os tipos de amostras de proteínas e o marcador pode ser totalmente dissolvido antes da amostragem, é melhor centrifugar a amostra antes da amostragem e remover as partículas que não podem ser dissolvidas.
(2) A solução de dissolução da amostra pode ser adicionada de acordo com os requisitos dos kits de proteínas para padrões de peso molecular; se as amostras padrão e desconhecidas forem autoconfiguradas, siga a solução de dissolução da amostra de 0,5-1,0mg/L. Após a dissolução, transfira-o para o tubo Ep, coloque a tampa (você pode adicionar um clipe na tampa) e depois aqueça em banho-maria a 110 graus Celsius por 3 minutos (você pode fazer vários furos redondos com o mesmo diâmetro que o tubo Ep na placa fina de isopor, e o tubo Ep é colocado no chão até que a borda da tampa seja impedida de descer ainda mais, e então coloque a placa fina de isopor, que está expondo a maior parte do corpo do tubo Ep, em banho-maria fervente, e a placa fina de isopor flutua naturalmente no banho-maria fervente. A folha fina de isopor flutua naturalmente na superfície da água fervente, facilitando o acesso e o aquecimento, evitando respingos da água fervente.
Um lote de tubos Ep pode ser colocado em banho-maria fervente por momentos diferentes. (Não jogue os tubos Ep no banho-maria fervente, as tampas podem ser lavadas) e depois esfrie em temperatura ambiente para uso. Se a amostra não for usada por um longo período de tempo, armazene a amostra em uma geladeira a -20 graus Celsius e, quando necessário, aqueça a amostra em água fervente a 110 graus Celsius por 3 minutos em temperatura ambiente e resfrie-a antes de removê-la para uso e depois aplicar a amostra para remover os agregados subestáveis nas proteínas da amostra.
(3) Altere a solução tampão da amostra para que a amostra possa ser totalmente dissolvida e a quantidade de SDS seja suficiente.
Motivo: as bandas SDS estão ligadas eletroforeticamente a proteínas vizinhas. Além da amostragem excessiva e da dissolução incompleta da amostra, o vazamento dos poços da amostra do gel pode causar o alargamento das bandas eletroforéticas. O vazamento geralmente é causado por rachaduras entre o gel e a placa de vidro. Contramedidas: Neste momento, o gel só pode ser re-preparado, o pente deve ter cuidado ao puxar para cima a coesão do gel estiver concluída, a velocidade não deve ser muito rápida, a direção de puxar deve ser perpendicular à superfície do gel; para evitar rachaduras entre a placa de vidro em ambos os lados do gel e o gel, não aperte a placa de vidro em ambos os lados do gel no processo de preparação do gel.



